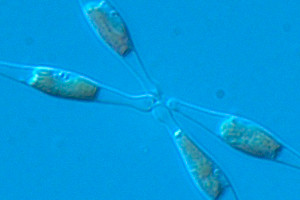
Général
Les diatomées représentent une des plus importantes groupes du phytoplancton. Ce sont des eucaryotes photosynthétiques et occupent une position centrale dans le contrôle des ressources marines et pour prédire les changements climatiques. Parallèlement à leur écologie, elles sont également intéressantes pour une meilleure connaissance de certains mécanismes évolutifs, car leurs génomes sont le résultat d’une fusion de trois génomes dérivés de leurs ancêtres. De plus, elles ont différentes applications en biotechnologie : en nanotechnologie pour leur silice, comme aliment en aquaculture et en tant que biofactory pour la production de molécules d’intérêt comme les acides gras de type omega-3, ainsi que les biocarburants. Jusqu’à présent, nous ne connaissons que très peu la biologie des diatomées.
Grace au séquençage complet du génome de la diatomée Phaeodactylum tricornutum (P. tricornutum) nous avons les informations de base pour étudier les questions importantes de la biologie des diatomées. De plus les connaissances sur les gènes de P. tricornutum faciliteront l’utilisation de cet organisme comme cellule potentielle pour l’expression de gènes d’autres algues brunes, intéressants pour l’industrie.
Reproduction
Cycle de vie : une division par jour. Synchronisation du cycle possible. Reproduction sexuelle jamais observée en culture.
Les Diatomées ont un cycle de vie essentiellement diplophasique. Les cellules diploïdes se multiplient par mitose pendant plusieurs mois, voire plusieurs années. Cependant, à chaque division cellulaire, l’une des deux diatomées-filles est de taille inférieure à la diatomée initiale, alors que l’autre fille est de même taille. Par conséquent, au cours des divisions successives, des diatomées plus petites apparaissent et l’une des lignées de descendantes voit sa taille diminuer à chaque génération. Cette diminution ne dure pas indéfiniment. En dessous d’un certain seuil (30% de la taille initiale), ces cellules entrent en méiose et produisent des gamètes. Le zygote issu de la fusion des gamètes (auxospore) croît jusqu’à la taille maximale propre à l’espèce ou à la population.
Outils
- Banques de cDNAs (130000), Banques de small RNAs (240,000)
- Transformation génétique en routine par biolistique, conjugaison et electroporation
- Vecteurs de transformation de type Gateway™ et uLoop
- Banques double hybride
- Outils pour des analyses transcriptomiques et épigénomes
- Extinction de gènes via RNAi et CRISPR/Cas9
- Outils bio-informatiques : genome et epigenome browser and digital gene expression database
Bases de données
Bases de données génomiques :
http://genome.jgi-psf.org/Phatr2/Phatr2.home.html
Bases de données transcriptomiques et épigénomique :
https://protists.ensembl.org/Phaeodactylum_tricornutum/Info/Index
Infrastructures
- UMR 8197 Institut de Biologie de l’Ecole normale supérieure (IBENS), Ecole Normale Supérieure, CNRS, INSERM, Université PSL - équipe de Chris Bowler, Génomique des Plantes et Algues
- http://www.ibens.ens.fr/?rubrique36
- Paris
- UMR7141 Biology and Light-sensing in Microalgae, Institut de Biologie Physico-Chimique - équipe d'Angela FALCIATORE
- http://www.ibpc.fr/UMR7141/en/home/
- angela.falciatore@ibpc.fr
- Paris
- Institut National des Sciences Appliquées de Toulouse - équipe Biologie synthétique chez les microalgues(INSA) - équipe de Faiza DABOUSSI
- http://www.toulouse-biotechnology-institute.fr/fr/la_recherche/pole-ingenierie-metabolique/biologie-synthetique-chez-les-microalgues.html
- fayza.daboussi@insa-toulouse.fr
- Versailles
- UFR Sciences Pharmaceutiques et biologiques - Laboratoire Mer, Molécules, Santé (EA 2160 MMS) - Université du Maine à Le Mans - équipe MIMMA (Benoit SCHOEFS)
- https://mms.univ-nantes.fr/
- benoit.schoefs@univ-lemans.fr
- Nantes
Experts
- Chris BOWLER
- cbowler@biologie.ens.fr
- UMR 8197 Institut de Biologie de l’Ecole normale supérieure (IBENS), Ecole Normale Supérieure, CNRS, INSERM, Université PSL, Paris
Bibliographie
- Articles
De Martino, A., Meichenin, A., Shi, J., Pan, K. and Bowler, C. Genetic and phenotypic characterisation of Phaeodactylum tricornutum (Bacillariophyceae) accessions. J. Phycol. 43: 992-1009 (2007).
Bowler C. et al. The Phaeodactylum genome reveals the evolutionary history of diatom genomes. Nature, 456: 239-244 (2008).
Bowler, C. and Falciatore, A. Genome of the Month: Phaeodactylum tricornutum. Trends Genet. 35:706-707 (2019).
Karas, B.J. et al. Designer diatom episomes delivered by bacterial conjugation. Nat. Commun. 6, 6925 (2015).
Nymark, M. et al. A CRISPR/Cas9 system adapted for gene editing in marine algae. Sci. Rep. 6, 24951 (2016).
Rastogi, A. et al. Integrative analysis of large scale transcriptome data draws a comprehensive landscape of Phaeodactylum tricornutum genome and evolutionary origin of diatoms. Sci. Rep. 8, 4834 (2018).
Serif, M. et al. One-step generation of multiple gene knock-outs in the diatom Phaeodactylum tricornutum by DNA-free genome editing. Nat. Commun. 9, 3924 (2018).
- Ressources web