- This page is currently being translated, sorry for the inconvenience.
Général
Les cnidaires sont les métazoaires les plus primitifs à être constitués de cellules épithéliales, de neurones, de cellules souches, d’une matrice extracellulaire complexe, de fibres musculaires et d’un axe de symétrie fixe. Le phylum des cnidaires occupe en effet une position critique dans l’arbre de la vie : il se trouve à la transition entre les métazoaires diploblastiques (animaux pluricellulaires composés de deux feuillets : l’endoderme et l’ectoderme) et les métazoaires triploblastiques (animaux pluricellulaires composés de trois feuillets : l’endoderme, le mésoderme et l’ectoderme). L’étude de leur développement permet de mieux comprendre l’émergence, l’élaboration et les mécanismes génétiques qui sous-tendent le plan d’organisation du corps.
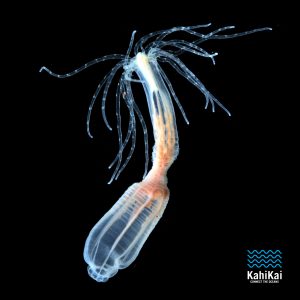
L’anémone de mer, Nematostella vectensis (N. vectensis), est un organisme modèle d’excellence pour la compréhension du développement des cnidaires. Elle présente plusieurs avantages, parmi lesquels nous pouvons citer : l’élevage et la manipulation aisés en laboratoire, contrôle de la ponte et du moment de fécondation, son génome séquencé et la disponibilité de nombreuses données et outils moléculaires, génomiques et génétiques pour étudier le dévéloppement embryonnaire, la régénération et la génétique des populations.
Reproduction
Le mode de reproduction de N. vectensis est à la fois sexuel et asexuel. Un adulte peut provenir de quatre processus développementaux distincts : l’embryogenèse classique, la régénération et deux formes de fissions asexuelles.
Reproduction sexuelle :
Les gamètes de N. vectensis sont produits tout au long de l’année et la ponte peut être induite par un stimulus lumineux. En fonction de la taille de la colonie, la ponte peut-être induite tous les jours donnant ainsi accès au matériel biologique en permanence. La vitesse de développement de N. vectensis est température-dépendante et en laboratoire l’animal devient sexuellement mature entre 4-6 mois. Les œufs ont un diamètre compris entre 170 et 240 µm et sont englobés dans une gélatine mucoïde lorsqu’ils sont relâchés. La larve, appelée planula, est ciliée et sphérique, et émerge entre 36 et 48 heures après fertilisation. Ces larves sont mobiles pendent quelques jours puis perdent leur motilité, métamorphosent et forment leur tentacules. Les juvéniles possèdent quatre tentacules et deux mesentères en cours de formation alors que les adultes possèdent environ seize tentacules et huit mesentères. Les mésentères sont les organes reproducteurs de l’animal.
Régénération :
Cette anémone de mer possède également de fortes capacités régénératives suivant une bisection, qui sont présent dans des animaux juvéniles et adultes. La régénération du corps entier est dite bidirectionnelle puisque suivant une bissection, la moitié orale régénérera une nouvelle partie aborale et la moitié aborale régénérera une nouvelle tête en environ sept jours. La cicatrisation se fait avant six heures suivant l’amputation et est prolifération indépendante alors que la régénération per se est prolifération dépendente. La régénération des structures orales peut être analysée en détail graçe à des étapes caractéristiques qui sous-tendent ce processus.
Reproduction asexuelle :
La reproduction asexuelle s’effectue principalement par fission transverse, soit par bourgeonnement, événement beaucoup plus rare. La fission transverse a lieu la nuit, et seulement chez des individus assez larges. Les individus subissent une constriction et deux individus complets sont formés à partir des fragments produits. Lors de la reproduction par bourgeonnement, un nouveau pôle oral se forme au niveau du pôle aboral (polarité inverse), la partie centrale s’étend et le reste du corps se forme. Une constriction au niveau du nouveau pôle aboral permet de séparer les deux corps.
Outils
- Micro-injection dans les oocytes
- Extinction partielle (Knock-Down) de gènes par morpholino, RNAi
- Extinction complète (Knock-Out) de gène par ingénierie génétique (CRISPR/Cas9)
- Possibilité de suivre l'expression d'un gène grâce à des gènes rapporteurs. Ceci est fait soit par la sur-expression d’ARNm ou d’ADN, ou par la création d’animaux trangéniques (Meganuclease, CRISPR/Cas9).
Bases de données
Bases de données générales :
(article référent : http://nar.oxfordjournals.org/cgi/content/full/34/suppl_1/D495)
Bases de données génomiques :
https://www.ncbi.nlm.nih.gov/genome?term=txid45351%5Borgn%5D
https://mycocosm.jgi.doe.gov/Nemve1/Nemve1.home.html
Banque de microARNs :
http://www.mirbase.org/textsearch.shtml?q=nematostella+vectensis&submit=submit
Profils d’expressions :
Infrastructures
Experts
- Eric RÖTTINGER
- Eric.ROTTINGER@unice.fr
- Institute for Research on Cancer and Aging -IRCAN – CNRS UMR7284 / INSERM U1081, Université Côte d’Azur, Nice
Bibliographie
- Articles
- Darling JA, Reitzel AR, Burton PM, Mazza ME, Ryan JF, Sullivan JC, et al. Rising starlet: the starlet sea anemone, Nematostella vectensis. Bioessays. 2005 Feb;27(2):211–21.
https://www.ncbi.nlm.nih.gov/pubmed/15666346
- Putnam NH, Srivastava M, Hellsten U, Dirks B, Chapman J, Salamov A, et al. Sea anemone genome reveals ancestral eumetazoan gene repertoire and genomic organization. Science. 2007 Jul 6;317(5834):86–94.
https://www.ncbi.nlm.nih.gov/pubmed/17615350
- Layden MJ, Röttinger E, Wolenski FS, Gilmore TD, Martindale MQ. Microinjection of mRNA or morpholinos for reverse genetic analysis in the starlet sea anemone, Nematostella vectensis. Nat Protoc. 2013 Apr 10;8(5):924–34.
https://www.ncbi.nlm.nih.gov/pubmed/23579781
- Layden MJ, Rentzsch F, Röttinger E. The rise of the starlet sea anemone Nematostella vectensis as a model system to investigate development and regeneration. WIREs Dev Biol. John Wiley & Sons, Inc; 2016 Feb 19.
https://www.ncbi.nlm.nih.gov/pubmed/26894563
- Reitzel A, Burton P, Krone C, Finnerty J. Comparison of developmental trajectories in the starlet sea anemone Nematostella vectensis: embryogenesis, regeneration, and two forms of asexual fission. Invertebrate Biology. 2007;126(2):99–112.
https://onlinelibrary.wiley.com/doi/full/10.1111/j.1744-7410.2007.00081.x
- Bossert PE, Dunn MP, Thomsen GH. A staging system for the regeneration of a polyp from the aboral physa of the anthozoan cnidarian nematostella vectensis. Dev Dyn. 2013 Jul;:n/a–n/a.
https://www.ncbi.nlm.nih.gov/pubmed/23913838
- Amiel AR, Johnston HT, Nedoncelle K, Warner JF, Ferreira S, Röttinger E. Characterization of Morphological and Cellular Events Underlying Oral Regeneration in the Sea Anemone, Nematostella vectensis. Int J Mol Sci. 2015;16(12):28449–71.
https://www.ncbi.nlm.nih.gov/pubmed/26633371
- Stefanik DJ, Friedman LE, Finnerty JR. Collecting, rearing, spawning and inducing regeneration of the starlet sea anemone, Nematostella vectensis. Nat Protoc. 2013 Apr 11;8(5):916–23.
https://www.ncbi.nlm.nih.gov/pubmed/23579780
- Fritzenwanker JH, Technau U. Induction of gametogenesis in the basal cnidarian Nematostella vectensis (Anthozoa). Dev Genes Evol. 2002 Feb 21;212(2):99–103.
https://www.ncbi.nlm.nih.gov/pubmed/11914942
- Ikmi A, McKinney SA, Delventhal KM. Gibson MC. TALEN and CRISPR/Cas9-mediated genome editing in the early-branching metazoan Nematostella vectensis. Nat Com. 2014 Nov 24;5:5486